NFE 2017 - Body Fitness - overall
Enorma nyheter, D-Friends: Det nya snabbverkande inhalerbara insulin som kallas Afrezza har just fått FDA-godkännande!
Den tredje gången är charmen för denna nya formulering av inhalerbart insulin, det andra som någonsin gör det genom den amerikanska regulatoriska processen efter Pfizers misslyckade Exubera den bättre delen av ett decennium sedan.
På fredag fick Kalifornien bioteknikföretaget MannKind Corp slutligen regleringsavstånd för sin Afrezza-enhet.

Nu, efter att ha skickat Afrezza i oktober 2013, har MannKind äntligen övertygat FDA om att den är redo att komma i händerna på vuxna med diabetes!
Vi berättas av MannKinds ledande befattningshavare att de arbetar för att hitta en pharma-partner för att tillverka och distribuera Afrezza, och produkten kan göras tillgänglig i januari eller slutet av första kvartalet 2015. > I FDA: s pressmeddelande som utgavs på fredag, säger doktor Jean-Marc Guettier av byråns division av metabolism och endokrinologiprodukter: "Dagens godkännande breddar de alternativ som finns tillgängliga för att leverera mealtiminsulin i den övergripande hanteringen av patienter med diabetes som behöver det för att kontrollera blodsockernivån. "
Afrezza är ett ultrarapidverkande insulin i pulverform som är utformat som ett insulin före måltid för vuxna (ännu inte för barn ) med typ 1 eller typ 2 diabetes. Det syftar till blodsockerpigar efter måltid, vilket innebar att det användes med befintlig insulinbehandling och inte var avsedd att vara en fristående insulinbehandling.
Pulveriserat insulin administreras via en whistle-sized inhalator kallad Dreamboat, som utvecklades efter den första FDA-rundan och orsakade förseningar eftersom byrån ville ha mer kliniska studier med den nya inhalatorn. Pulvret löses omedelbart när det inandas i lungorna, och insulinet dumpas sedan snabbt i blodomloppet för att börja arbeta. Afrezza toppar inom 12 till 15 minuter och är ute av systemet inom en timme, jämfört med nuvarande kortvariga insuliner som vanligtvis tar minst 20 minuter att sparka in, toppa 2-3 timmar och kan stanna i systemet för att så länge som fem timmar.
Naturligtvis är den största överklagan att det kräver inga nålar, men bara en liten handhållen inhalator som verkligen ser ut som en visselpipa.Drömbåten är avsedd att kastas bort efter 15 dagar för att förhindra att något pulver uppbyggs inuti som kan täppa till enheten. Till skillnad från traditionellt insulin behöver det ingen kylning, men hålls snarare vid rumstemperatur. Varje enstaka patron rymmer antingen 4 eller 8 enheter, och vid den tidpunkt då Afrezza är kommersialiserad kan det finnas en 12-enhetskassett tillgänglig.
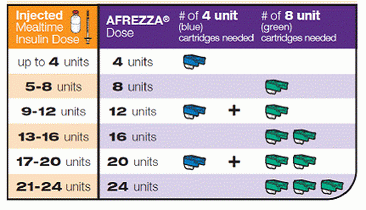
Så här kan du dosera för det, omvandla aktuell insulininjektion eller bolusmängder till en afrezza-vänlig inhalerbar dos:
Personligen verkar det inte som mycket insulin för att täcka några av de måltider jag äter som kräver högre doser … Jag skulle gå igenom en hel massa av de små patronerna. Så för vissa PWDs kan den här enheten presentera en logistisk utmaning när det gäller att enkelt dosera de mängder vi behöver …? Men då igen kan det vara ett bra verktyg för att slå ned envisa högblodsocker med korrigeringsdosering.
I en telefonsamtal sent på fredagen berättade MannKinds president Hakan Edstrom att företaget ännu inte har slutfört några avtal med potentiella partners för att tillverka och distribuera Afrezza. Men det blir nära och i samtal med ett antal företag att slutföra ett partnerskap så snart som möjligt.
Kostnaderna förblir TBD (mycket beror på det potentiella partnerskapet), men Edstrom säger att de förväntar sig att priserna ligger i samma räckvidd som vad vi vanligtvis betalar för insulinpennor i USADetta godkännande är en HUGE utveckling, och det har gått länge, åtta år sedan detta uppdrag började av Alfred Mann - mannen som grundade Minimed innan den så småningom köptes av Medtronic. Vi har följt Afrezza-historien i flera år på "
Mine - från de första FDA-ansökningsdagarna när MannKind hade sin första klumpiga design, till den senaste täckningen om hur Afrezza används i artificiella bukspottkörteln kliniska tester.
Före förra årets FDA-återuppgift hörde vi att MannKind pratar om sina kliniska fas III-studier förra sommaren som inkluderade 500 + typ 1 PWD i USA och globalt vilket tyder på att företaget var redo att försöka sin hand igen med FDA.
Den rådgivande kommitté som träffades den 1 april i år röstade 13 till 1 att Afrezza var säker och effektiv nog för godkännande som behandling för typ 1-diabetes, med den ensamstående dissidenten David Cooke röstade att riskerna övervägde fördelarna för typen 1s.Han pekade på den interna FDA-översynen som visade att vissa patienter som tagit Afrezza slutade behandling efter att ha utvecklat bronkialpasmer, hosta och en minskning av deras lungs funktion. Men ingen av dessa bekymmer kom upp under omröstningen på Afrezza för typ 2-användning, och utskottet beslutade enhälligt med 14-0 röster.

Det rekommenderas inte för personer med diabetes som röker eller för behandling av diabetisk ketoacidos (DKA).
Afrezza är endast godkänd för vuxna, inte barn. Byrån begär dock en klinisk studie efter kliniken för att utvärdera säkerheten och användningen hos barn.
- FDA kräver en boxad varning och rekommenderar att vissa personer med astma och kronisk obstruktiv lungsjukdom (KOL) som har använt Afrezza har haft akut bronkospasm. Som ett resultat av detta, bör patienter med kronisk lungsjukdom, astma eller KOL, inte använda Afrezza på grund av denna risk. De vanligaste biverkningarna i samband med Afrezza i kliniska prövningar var hypoglykemi, hosta och halsvärk eller irritation.
- En del av godkännandekraven är en riskbedömnings- och bekämpningsstrategi, som måste innehålla en kommunikationsplan för att informera vårdpersonal om den allvarliga risken för akut bronkospasm i samband med Afrezza. Det är viktigt att se till att fördelarna överväger de potentiella riskerna med att använda Afrezza.
- Andra eftermarknadsstudier krävs för Afrezza, till exempel: klinisk prövning för att utvärdera den potentiella risken för lungmalignitet vid användning (detta försök kommer också att bedöma kardiovaskulär risk och den långsiktiga effekten av Afrezza på lungfunktionen); och två farmakokinetiska-farmakodynamiska euglykemiska glukos-klampa kliniska prövningar, en för att karakterisera dosrespons och en för att karakterisera individsvariation.
- Edstrom berättade för oss att de planerar att påbörja pediatriska prövningar så snart som möjligt, vilket kommer realistiskt att börja någon gång i mitten av 2015. Det betyder att Afrezza kanske inte godkänns för barn med diabetes fram till 2017, och att regleringsförfarandet kan variera beroende på vad eftermarknadsstudierna och användarupplevelsen visar under tiden.
- Och trots det gröna ljuset från FDA finns det ingen garanti Afrezza kommer se kommersiell framgång eller att PWD kommer att flocka för att använda den. Som noterat har MannKind ännu inte säkrat några pharma-partners redo att sälja Afrezza. Men om MannKinds resultatuppringning i maj är någon indikation på vad som händer snart, kanske ett potentiellt partnerskap inte är långt ifrån.
Från investerarens synvinkel är många skeptiska på grund av det misslyckade Exubera inhalerade insulin som har format mycket av diskussionen om Afrezza under de senaste åren. Den gemensamma Pfizer-Sanofi-produkten drogs från marknaden under 2007 efter mer än ett års värde av under-försäljning, vilket resulterade i en rekordbrytande $ 2. 8 miljarder förlust för leverantörerna.
Man säger självklart att Afrezza är väsentligt annorlunda, främst eftersom Exubera använde en klumpig fotlång inhalator och var kopplad till en högre risk för lungcancer som Pfizer inte kunde övervinna.
Vi ser vad D-gemenskapen tänker nu med Afrezza, speciellt med all den AP-kliniska prövning som den har haft nyligen. Oavsett om det är tillräckligt att övertyga massorna är det ännu oklart …
Inhale nyheterna för nu och vi kommer se hur lång tid det tar för oss alla att andas och vända denna spänning till verklig försäljning och utbredd användning.
Ansvarsfraskrivelse
: Innehåll skapat av Diabetes Mine-laget. För mer information klicka här.
Ansvarsbegränsning Detta innehåll skapas för Diabetes Mine, en konsumenthälsoblog som fokuserar på diabetesområdet. Innehållet är inte medicinskt granskat och följer inte Healthlines redaktionella riktlinjer. För mer information om Healthlines partnerskap med Diabetes Mine, vänligen klicka här.Inandad Insulin Afrezza har fått FDA godkännande

Godkänt FDA en ny inhalerad insulinprodukt. Afrezza är ett ultrarapidverkande insulin i pulverform, utformad som en före måltid för diabetiker av typ 1.
Inandad insulin godkänd av FDA: Talar om OC?

Afrezza, afrezza 4 enhet (30) - 8 enhet (60), afrezza 4 enhet (60) - 8 enhet (30) (insulin (inhalation)) biverkningar, interaktioner, användningar och läkemedelsavtryck

Läkemedelsinformation om Afrezza, Afrezza 4 enhet (30) - 8 enhet (60), Afrezza 4 enhet (60) - 8 enhet (30) (insulin (inandning)) inkluderar läkemedelsbilder, biverkningar, läkemedelsinteraktioner, användningsanvisningar, symptom på överdosering och vad man ska undvika.


